Cruciaal voor een optimale vorming van het menselijk microbioom, zijn de eerste twee à drie jaren – en dan met name de eerste uren – van ons leven.
Want hoewel uiteindelijk alle kinderen uiteindelijk een volwassen microbioom ontwikkelen, lijkt er sprake te zijn van een gevoelige periode: een tijdsspanne waarin onze lichaamsoppervlakken (de huid en de slijmvliezen van het spijsverteringsstelsel, de luchtwegen en het urogenitale stelsel) het meest gevoelig zijn voor kolonisatie van microwezens, en de initiële kolonisatie plaatsvindt die bepalend is voor een optimale ontwikkeling en functioneren van deze lichaamsoppervlakken (Houghteling & Walker, 2015).
Zoals het geval is bij de meeste diersoorten, dragen ook mensenmoeders hun eigen microbiota tijdens de geboorte over op kun kinderen. Deze vorm van overdracht vindt met name plaats wanneer baby’s bij het passeren van het geboortekanaal worden blootgesteld aan het urogenitale, darm- en huidmicrobioom van hun moeder en zich vervolgens voeden aan de moedermelk en de microbiota die deze bevat (Palmer et al., 2007; Funkhouser & Bordenstein, 2013).
De microbiota-overdracht die plaatsvindt tussen moeder en kind gedurende de geboorte en in de maanden er na, functioneert in feite als een ‘natuurlijke inenting’.
 Baby’s eerste kennismaking met microwezens
Baby’s eerste kennismaking met microwezens
Men heeft lange tijd aangenomen dat foetussen in de baarmoeder in een volkomen steriele omgeving verblijven, die pas verbroken wordt bij de geboorte. Naar aanleiding van een aantal recente onderzoeken, is er echter sprake van een veranderende visie. Er zijn namelijk minieme hoeveelheden bacteriën gevonden in de navelstreng en meconium van pasgeboren baby’s, en onlangs is gebleken dat de placenta een eigen microbioom heeft (Jiménez et al., 2008; Satokari et al., 2009; Funkhouser & Bordenstein, 2013; Agaard et al., 2014).
Wellicht dat de leefomgeving van foetussen dus niet volkomen steriel is, maar dat immuuncellen van de moeder via de navelstreng enkele bacteriën naar de foetus leiden als een eerste soort kennismaking met de microscopische wezens waar het kind na de geboorte mee te maken krijgt (Hansen et al., 2015).
Gedurende de zwangerschap verandert het darmmicrobioom ingrijpend, wat waarschijnlijk wordt veroorzaakt doordat de vrouw zowel zichzelf als de foetus moet voorzien van voedingsstoffen. Tijdens de laatste weken van de zwangerschap wordt ook het microbioom van het geboortekanaal van de moeder speciaal aangepast aan de behoeften van het pasgeboren kind. Het microbioom bevat dan met name melkzuurbacteriën die de baby helpen om melk af te kunnen breken, en die in staat zijn te voorkomen dat concurrerende of zelfs schadelijke bacteriën zich in de ingewanden van de baby kunnen nestelen (Koren et al., 2012).
Wordt de baby vervolgens gevoed met moedermelk, dan krijgt het naast water en voedingsstoffen tevens het moedermelkmicrobioom binnen: de microbiota die de moeder overdraagt aan haar kind door middel van het geven van borstvoeding. De bacteriën die aanwezig zijn in de moedermelk beschermen de baby tegen infecties en dragen bij aan de vorming van het darmmicrobioom, het functioneren van het spijsverteringsstelsel en de ontwikkeling van het immuunsysteem (Mueller et al, 2015; Rautava, 2016).
Het moedermelkmicrobioom verandert naarmate de baby ouder wordt en andere behoeften krijgt, waardoor het colostrum dat net na de geboorte wordt geproduceerd een wezenlijk andere bacteriesamenstelling heeft dan de moedermelk die de baby krijgt wanneer het een aantal maanden oud is (Cabrera-Rubio et al., 2012).
Het lichaam van de baby zelf is overigens geen machteloze toeschouwer van zijn eigen kolonisatie, maar speelt hier een actieve rol in. Omdat een pasgeboren baby amper maagzuur produceert, zijn microwezens in staat om het spijsverteringsstelsel te koloniseren. Deze kolonisatie gebeurt volgens een vast patroon, waarbij de wanden van het spijsverteringsstelsel eerst bevolkt worden door (facultatief) aerobe bacteriën (bacteriën die van zuurstof (kunnen) leven), zoals Enterobacteriën, Enterokokken en Stafylokokken. Door de aanwezige zuurstof te verbruiken veranderen zij het interne milieu, waardoor er ruimte ontstaat voor de kolonisatie van strikt anaerobe bacteriën (bacteriën levend zonder zuurstof), zoals Bifidobacteriën, Clostridiabacteriën en Bacteroïdes (Adlerberth, 2008).
Daarnaast beschikt elke baby over een aangeboren immuunsysteem. Met behulp van patroonherkenningsmoleculen zoals ‘Toll-like’ receptoren (TLR’s), zijn de verschillende lichaamsoppervlakken (de huid en slijmvliezen van het spijsverteringsstelsel, luchtwegstelsel en urogenitale stelsel) in staat om microwezens te herkennen, te bepalen of ze al dan niet pathogeen van aard zijn en om indien nodig een immuunreactie op te starten (Medzhitov, 2001).
 Verstoringen in de microbiota-overdracht tussen moeder en kind
Verstoringen in de microbiota-overdracht tussen moeder en kind
Voor de microbiota-overdracht tussen moeder en kind geldt allereerst, dat de moeder alleen in staat is over te dragen wat zij heeft, namelijk haar eigen microbioom, waarvan de kwaliteit per moeder verschilt. Zo is bijvoorbeeld de diversiteit van de moedermelk kleiner wanneer de moeder last heeft van overgewicht (Cabrera-Rubio et al., 2012).
Naast de kwaliteit van het microbioom van de moeder, zijn er nog een aantal factoren die een bedreiging vormen voor de natuurlijke inenting: geboorte middels een keizersnee, het gebruik van kunstvoeding en blootstelling aan antibiotica (Penders et al., 2006; Fallani et al., 2010; Scholtens et al., 2012; Matamoros et al., 2013; Mueller et al, 2015).
Het effect van een keizersnee op het zich ontwikkelende microbioom
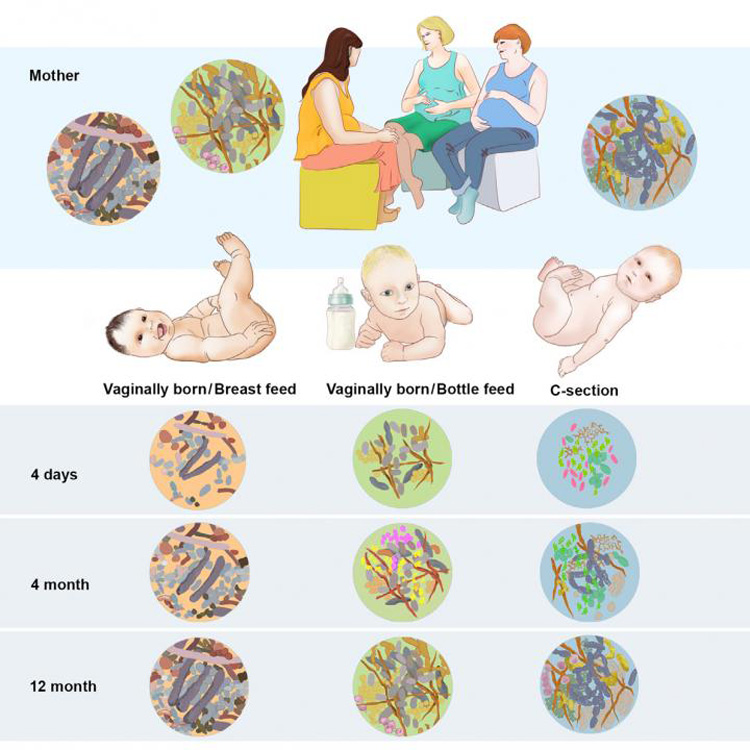
Baby’s die ter wereld komen middels een keizersnee, passeren bij de geboorte niet het geboortekanaal van de moeder en ontvangen dus ook niet de natuurlijke inenting die zo belangrijk is voor met name de eerste levensfase van het kind. Het gevolg is dat baby’s geboren met behulp van een keizersnee een wezenlijk ander microbioom hebben dan vaginageborenen. Zij zijn namelijk met name gekoloniseerd door huidmicroben in plaats van vaginale microben. Als gevolg hebben keizersneebaby’s een significant minder divers darmmicrobioom, dat bestaat uit minder ‘gunstige’ en meer ‘ongunstige’ bacteriën en dat bovendien minder allergie-onderdrukkende immuuncellen bevat (Grölund, 1999; Penders et al., 2006; Dominguez-Bello et al., 2010; Azad et al., 2013; Song et al., 2013; Kulas et al., 2013; Jakobsson et al., 2014).
Inmiddels zijn er een aantal grootschalige meta-analyses uitgevoerd naar de lange termijn consequenties voor de gezondheid van kinderen die zijn geboren middels een keizersnee. In tegenstelling tot kinderen die op natuurlijke wijze geboren zijn, lopen keizersneekinderen een groter risico op het ontwikkelen van verschillende ziektes die allemaal gelinkt zijn aan een suboptimaal microbioom, namelijk:
- astma (Thavagnanam et al., 2008; Huang et al., 2014);
- allergische rhinitis (Bager et al., 2008);
- diabetes type 1 (juveniele diabetes) (Cardwell et al., 2008), en
- overgewicht (Li et al., 2013; Darmasseelane et al., 2014).
Tenslotte zijn moeders die hun kind middels een keizersnee ter wereld hebben gebracht over het algemeen minder geneigd om hun kind borstvoeding te geven dan moeders die op een natuurlijke wijze bevallen zijn (DiMatteo et al., 1996; Prior et al., 2012). Dit terwijl moedermelk veel beter is voor de ontwikkeling van het microbioom van de baby dan kunstvoeding.
Het effect van kunstvoeding op het zich ontwikkelende microbioom
Het darmmicrobioom en de ontlasting van baby’s die moedermelk krijgen, verschilt in significante mate van baby’s die gevoed worden met kunstmelk. Bij baby’s gevoed met moedermelk domineert de melkzuurbacterie bifidobacterium, terwijl het microbioom van baby’s gevoed met kunstmelk slechts de helft van dit aantal bifidobacteriën bevat; zij op hun beurt hebben ontlasting die meer andere bacteriën bevat (zoals atopobium en bacteroides) (Harmsen et al., 2000; Penders et al., 2006; Fallani et al., 2010; Bezirtzoglou et al.,, 2011).
Baby’s die uitsluitend worden gevoed met kunstvoeding, kunnen niet profiteren van het moedermelkmicrobioom dat de baby beschermt tegen infecties en bijdraagt aan de vorming van het spijsverteringsstelsel en de ontwikkeling van het immuunsysteem (Le Huërou-Luron et al., 2010; Fernández et al., 2013; Mueller et al, 2015).
Natuurlijk heeft dit gevolgen voor de gezondheid van baby’s op zowel korte als langere termijn. Ook naar de gezondheidseffecten van borstvoeding versus kunstvoeding zijn inmiddels een flinke hoeveelheid grootschalige meta-analyses uitgevoerd. Deze effecten kunnen niet per definitie (compleet) toegeschreven worden aan veranderingen in het microbioom, maar zijn er wel aan gerelateerd.
Baby’s die borstvoeding hebben gekregen in plaats van kunstvoeding, hebben:
- een betere cognitieve ontwikkeling (Anderson et al., 1999; Kramer et al., 2008);
- een lager risico op overlijden aan wiegendood (Hauck et al., 2011);
- een lager risico op het ontwikkelen van ernstige luchtweginfecties (Bachrach et al., 2003);
- een lager risico op het ontwikkelen van overgewicht (Arenz et al., 2004; Harder et al., 2005);
- een lager risico op het krijgen van astma, atopische dermatitis (Gdalevich et al., 2001a, 2001b) en allergische rhinitis (Bloch et al., 2002), en
- een lager risico op het ontwikkelen van diabetes type 2 (Horta et al., 2007).
Wellicht dat borstvoeding ook een lager risico geeft op ontwikkeling van het prikkelbare darmsyndroom (Klement et al., 2004), een hoge bloeddruk en een hoog cholesterolgehalte; meer onderzoek hiernaar is nodig (Martin et al., 2005; Horta et al., 2007).
Het effect van blootstelling aan antibotica op het zich ontwikkelende microbioom
Antibiotica waarvan bekend is dat deze ontwikkelingsstoornissen bij het ongeboren kind kunnen veroorzaken, worden natuurlijk niet aan zwangere vrouwen voorgeschreven.
Maar ook de als ‘veilig’ beschouwde antibiotica hebben een negatieve invloed. Antibioticagebruik tijdens de zwangerschap, gedurende de geboorte en/of (vlak) na de geboorte, verstoort de opbouw van een gezond microbioom. Het leidt tot een verminderde aanwezigheid van melkzuurbacteriën (bifidobacteria and lactobacilli) in de darmen en is geassocieerd met een verminderde bacteriële diversiteit van baby’s darmmicrobioom en ontlasting (Tanaka et al., 2009; Arboleya et al., 2015; Fouhy et al., 2012).
Samengevat…
Voor de (toekomstige) gezondheid van het kind is het van groot belang dat door ouders en zorgverleners vanaf de geboorte aandacht wordt besteed aan de opbouw van een goed microbioom (Castanys-Muñoz et al., 2016).Baby’s die het meest gunstige microbioom lijken te hebben (Penders et al., 2006), zijn degenen die:
- op tijd geboren worden (tussen de 38 en 42 weken);
- middels een vaginale bevalling;
- die thuis heeft plaatsgevonden in plaats van in het ziekenhuis;
- die niet zijn blootgesteld aan antibiotica, en
- de eerste 6 maanden exclusief gevoed zijn met borstvoeding.
Een gezond microbioom is natuurlijk niet de enige gezondheidsfactor waarmee rekening moet worden gehouden. De keuze voor een vaginale bevalling/keizersnede, borstvoeding/flesvoeding, of het al dan niet gebruiken van antibiotica is sterk afhankelijk van de specifieke omstandigheden!
Bronnenlijst
Aagaard, K., Ma, J., Antony, K. M., Ganu, R., Petrosino, J., & Versalovic, J. (2014). The placenta harbors a unique microbiome. Science translational medicine, 6(237), 237ra65-237ra65.
Adlerberth, I. (2008). Factors influencing the establishment of the intestinal microbiota in infancy. Nutr. Workshop. Ser. Pediatr. Program., 62: 13–29.
Anderson, J. W., Johnstone, B. M., & Remley, D. T. (1999). Breast-feeding and cognitive development: a meta-analysis. The American journal of clinical nutrition, 70(4), 525-535.
Arboleya, S., Sánchez, B., Milani, C., Duranti, S., Solís, G., Fernández, N., … & Gueimonde, M. (2015). Intestinal microbiota development in preterm neonates and effect of perinatal antibiotics. The Journal of pediatrics, 166(3), 538-544.
Arenz, S., Rückerl, R., Koletzko, B., & von Kries, R. (2004). Breast-feeding and childhood obesity – a systematic review. International journal of obesity, 28(10), 1247-1256.
Azad, M. B., Konya, T., Maughan, H., Guttman, D. S., Field, C. J., Chari, R. S., … & Kozyrskyj, A. L. (2013). Gut microbiota of healthy Canadian infants: profiles by mode of delivery and infant diet at 4 months. Canadian Medical Association Journal, 185(5), 385-394.
Bachrach, V. R. G., Schwarz, E., & Bachrach, L. R. (2003). Breastfeeding and the risk of hospitalization for respiratory disease in infancy: a meta-analysis. Archives of pediatrics & adolescent medicine, 157(3), 237-243.
Bäckhed, F., Roswall, J., Peng, Y., Feng, Q., Jia, H., Kovatcheva-Datchary, P., … & Khan, M. T. (2015). Dynamics and stabilization of the human gut microbiome during the first year of life. Cell host & microbe, 17(5), 690-703.
Bager, P., Wohlfahrt, J., & Westergaard, T. (2008). Caesarean delivery and risk of atopy and allergic disesase: meta‐analyses. Clinical & Experimental Allergy, 38(4), 634-642.
Bezirtzoglou, E., Tsiotsias, A., & Welling, G. W. (2011). Microbiota profile in feces of breast-and formula-fed newborns by using fluorescence in situ hybridization (FISH). Anaerobe, 17(6), 478-482.
Bloch, A. M., Mimouni, D., Mimouni, M., & Gdalevich, M. (2002). Does breastfeeding protect against allergic rhinitis during childhood? A meta‐analysis of prospective studies. Acta Paediatrica, 91(3), 275-279.
Cabrera-Rubio, R., Collado, M. C., Laitinen, K., Salminen, S., Isolauri, E., & Mira, A. (2012). The human milk microbiome changes over lactation and is shaped by maternal weight and mode of delivery. The American journal of clinical nutrition, 96(3), 544-551.
Cardwell, C. R., Stene, L. C., Joner, G., Cinek, O., Svensson, J., Goldacre, M. J., … & Urbonaitė, B. (2008). Caesarean section is associated with an increased risk of childhood-onset type 1 diabetes mellitus: a meta-analysis of observational studies. Diabetologia, 51(5), 726-735.
Castanys-Muñoz, E., Martin, M. J., & Vazquez, E. (2016). Building a Beneficial Microbiome from Birth. Advances in Nutrition: An International Review Journal, 7(2), 323-330.
Darmasseelane, K., Hyde, M. J., Santhakumaran, S., Gale, C., & Modi, N. (2014). Mode of delivery and offspring body mass index, overweight and obesity in adult life: a systematic review and meta-analysis. PloS one, 9(2), e87896.
DiMatteo, M. R., Morton, S. C., Lepper, H. S., Damush, T. M., Carney, M. F., Pearson, M., & Kahn, K. L. (1996). Cesarean childbirth and psychosocial outcomes: a meta-analysis. Health psychology, 15(4), 303.
Dominguez-Bello, M. G., Costello, E. K., Contreras, M., Magris, M., Hidalgo, G., Fierer, N., & Knight, R. (2010). Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns. Proceedings of the National Academy of Sciences, 107(26), 11971-11975.
Fallani, M., Young, D., Scott, J., Norin, E., Amarri, S., Adam, R., … & Doré, J. (2010). Intestinal microbiota of 6-week-old infants across Europe: geographic influence beyond delivery mode, breast-feeding, and antibiotics. Journal of pediatric gastroenterology and nutrition, 51(1), 77-84.
Fernández, L., Langa, S., Martín, V., Maldonado, A., Jiménez, E., Martín, R., & Rodríguez, J. M. (2013). The human milk microbiota: origin and potential roles in health and disease. Pharmacological Research, 69(1), 1-10.
Fouhy, F., Guinane, C. M., Hussey, S., Wall, R., Ryan, C. A., Dempsey, E. M., … & Cotter, P. D. (2012). High-throughput sequencing reveals the incomplete, short-term recovery of infant gut microbiota following parenteral antibiotic treatment with ampicillin and gentamicin. Antimicrobial agents and chemotherapy, 56(11), 5811-5820.
Funkhouser, L. J., & Bordenstein, S. R. (2013). Mom knows best: the universality of maternal microbial transmission. PLoS Biol, 11(8), e1001631.
Gdalevich, M., Mimouni, D., & Mimouni, M. (2001a). Breast-feeding and the risk of bronchial asthma in childhood: a systematic review with meta-analysis of prospective studies. The Journal of pediatrics, 139(2), 261-266.
Gdalevich, M., Mimouni, D., David, M., & Mimouni, M. (2001b). Breast-feeding and the onset of atopic dermatitis in childhood: a systematic review and meta-analysis of prospective studies. Journal of the American Academy of Dermatology, 45(4), 520-527.
Grölund, M. M., Lehtonen, O. P., Eerola, E., & Kero, P. (1999). Fecal microflora in healthy infants born by different methods of delivery: permanent changes in intestinal flora after cesarean delivery. Journal of pediatric gastroenterology and nutrition, 28(1), 19-25.
Hansen, R., Scott, K. P., Khan, S., Martin, J. C., Berry, S. H., Stevenson, M., … & Hold, G. L. (2015). First-pass meconium samples from healthy term vaginally-delivered neonates: an analysis of the microbiota. PloS one, 10(7), e0133320.
Harder, T., Bergmann, R., Kallischnigg, G., & Plagemann, A. (2005). Duration of breastfeeding and risk of overweight: a meta-analysis. American journal of epidemiology, 162(5), 397-403.
Harmsen, H. J., Wildeboer–Veloo, A. C., Raangs, G. C., Wagendorp, A. A., Klijn, N., Bindels, J. G., & Welling, G. W. (2000). Analysis of intestinal flora development in breast-fed and formula-fed infants by using molecular identification and detection methods. Journal of pediatric gastroenterology and nutrition, 30(1), 61-67.
Hauck, F. R., Thompson, J. M., Tanabe, K. O., Moon, R. Y., & Vennemann, M. M. (2011). Breastfeeding and reduced risk of sudden infant death syndrome: a meta-analysis. Pediatrics, 128(1), 103-110.
Horta, B.L., Bahl, R., Martines, J.C. & Victora, V.G. (2007). Evidence on the long-term effects of breastfeeding. Systematic reviews and meta-analyses. World Health Organization.
Houghteling, P. D., & Walker, W. A. (2015). Why Is Initial Bacterial Colonization of the Intestine Important to Infants’ and Children’s Health?. Journal of pediatric gastroenterology and nutrition, 60(3), 294-307.
Huang, L., Chen, Q., Zhao, Y., Wang, W., Fang, F., & Bao, Y. (2014). Is elective cesarean section associated with a higher risk of asthma? A meta-analysis. Journal of Asthma, 52(1), 16-25.
Jakobsson, H. E., Abrahamsson, T. R., Jenmalm, M. C., Harris, K., Quince, C., Jernberg, C., … & Andersson, A. F. (2014). Decreased gut microbiota diversity, delayed Bacteroidetes colonisation and reduced Th1 responses in infants delivered by caesarean section. Gut, 63(4), 559-566.
Jiménez, E., Fernández, L., Marín, M. L., Martín, R., Odriozola, J. M., Nueno-Palop, C., … & Rodríguez, J. M. (2005). Isolation of commensal bacteria from umbilical cord blood of healthy neonates born by cesarean section. Current microbiology, 51(4), 270-274.
Jiménez, E., Marín, M. L., Martín, R., Odriozola, J. M., Olivares, M., Xaus, J., … & Rodríguez, J. M. (2008). Is meconium from healthy newborns actually sterile?. Research in microbiology, 159(3), 187-193.
Klement, E., Cohen, R. V., Boxman, J., Joseph, A., & Reif, S. (2004). Breastfeeding and risk of inflammatory bowel disease: a systematic review with meta-analysis. The American journal of clinical nutrition, 80(5), 1342-1352.
Koren, O., Goodrich, J. K., Cullender, T. C., Spor, A., Laitinen, K., Bäckhed, H. K., … & Bäckhed, F. (2012). Host remodeling of the gut microbiome and metabolic changes during pregnancy. Cell, 150(3), 470-480.
Kramer, M. S., Aboud, F., Mironova, E., Vanilovich, I., Platt, R. W., Matush, L., … & Collet, J. P. (2008). Breastfeeding and child cognitive development: new evidence from a large randomized trial. Archives of general psychiatry, 65(5), 578-584.
Kulas, T., Bursac, D., Zegarac, Z., Planinic-Rados, G., & Hrgovic, Z. (2013). New Views on Cesarean Section, its Possible Complications and Long-Term Consequences for Children’s Health. medical archives, 67(6), 460.
Lavender, T., Hofmeyr, G. J., Neilson, J. P., Kingdon, C., & Gyte, G. M. (2012). Caesarean section for non‐medical reasons at term. Cochrane Database Syst Rev, 3: CD004660.
Le Huërou-Luron, I., Blat, S., & Boudry, G. (2010). Breast-v. formula-feeding: impacts on the digestive tract and immediate and long-term health effects. Nutrition research reviews, 23(01), 23-36.
Li, H. T., Zhou, Y. B., & Liu, J. M. (2013). The impact of cesarean section on offspring overweight and obesity: a systematic review and meta-analysis. International journal of obesity, 37(7), 893-899.
Liu, S., Liston, R. M., Joseph, K. S., Heaman, M., Sauve, R., & Kramer, M. S. (2007). Maternal mortality and severe morbidity associated with low-risk planned cesarean delivery versus planned vaginal delivery at term. Canadian medical association journal, 176(4), 455-460.
Macfarlane, A. J., Blondel, B., Mohangoo, A. D., Cuttini, M., Nijhuis, J., Novak, Z., … & Zeitlin, J. (2015). Wide differences in mode of delivery within Europe: risk‐stratified analyses of aggregated routine data from the Euro‐Peristat study. BJOG: An International Journal of Obstetrics & Gynaecology.
Martin, R. M., Gunnell, D., & Smith, G. D. (2005). Breastfeeding in infancy and blood pressure in later life: systematic review and meta-analysis. American Journal of Epidemiology, 161(1), 15-26.
Matamoros, S., Gras-Leguen, C., Le Vacon, F., Potel, G., & de La Cochetiere, M. F. (2013). Development of intestinal microbiota in infants and its impact on health. Trends in microbiology, 21(4), 167-173.
Mazzoni, A., Althabe, F., Liu, N. H., Bonotti, A. M., Gibbons, L., Sánchez, A. J., & Belizán, J. M. (2011). Women’s preference for caesarean section: a systematic review and meta‐analysis of observational studies. BJOG: an international journal of obstetrics & gynaecology, 118(4), 391-399.
McCourt, C., Weaver, J., Statham, H., Beake, S., Gamble, J., & Creedy, D. K. (2007). Elective cesarean section and decision making: a critical review of the literature. Birth, 34(1), 65-79.
Medzhitov, R. (2001). Toll-like receptors and innate immunity. Nature Reviews Immunology, 1(2), 135-145.
Mueller, N. T., Bakacs, E., Combellick, J., Grigoryan, Z., & Dominguez-Bello, M. G. (2015). The infant microbiome development: mom matters. Trends in molecular medicine, 21(2), 109-117.
Palmer, C., Bik, E. M., DiGiulio, D. B., Relman, D. A., & Brown, P. O. (2007). Development of the human infant intestinal microbiota. PLoS Biol, 5(7), e177.
Penders, J., Thijs, C., Vink, C., Stelma, F. F., Snijders, B., Kummeling, I., … & Stobberingh, E. E. (2006). Factors influencing the composition of the intestinal microbiota in early infancy. Pediatrics, 118(2), 511-521.
Prior, E., Santhakumaran, S., Gale, C., Philipps, L. H., Modi, N., & Hyde, M. J. (2012). Breastfeeding after cesarean delivery: a systematic review and meta-analysis of world literature. The American journal of clinical nutrition, ajcn-030254.
Rautava, S. (2016). Early microbial contact, the breast milk microbiome and child health. Journal of developmental origins of health and disease, 7(01), 5-14.
Satokari, R., Grönroos, T., Laitinen, K., Salminen, S., & Isolauri, E. (2009). Bifidobacterium and Lactobacillus DNA in the human placenta. Letters in applied microbiology, 48(1), 8-12.
Scholtens, P. A., Oozeer, R., Martin, R., Amor, K. B., & Knol, J. (2012). The early settlers: intestinal microbiology in early life. Annual review of food science and technology, 3, 425-447.
Song, S. J., Dominguez-Bello, M. G., & Knight, R. (2013). How delivery mode and feeding can shape the bacterial community in the infant gut. Canadian Medical Association Journal, 185(5), 373-374.
Tanaka, S., Kobayashi, T., Songjinda, P., Tateyama, A., Tsubouchi, M., Kiyohara, C., … & Nakayama, J. (2009). Influence of antibiotic exposure in the early postnatal period on the development of intestinal microbiota. FEMS Immunology & Medical Microbiology, 56(1), 80-87.
Thavagnanam, S., Fleming, J., Bromley, A., Shields, M. D., & Cardwell, C. R. (2008). A meta‐analysis of the association between Caesarean section and childhood asthma. Clinical & Experimental Allergy, 38(4), 629-633.,/span>






Review mijn reviews